Revista Paraguaya de Reumatología, Vol. 1, Nº 1, 2015
ISSN 2413-4341
ORIGINAL
PRESENTACIÓN DE FIEBRE REUMÁTICA Y ARTRITIS POST-ESTREPTOCÓCICA EN UN HOSPITAL DE TERCER NIVEL
Julián Vega1, Zoilo Morel2, Renee Szwacko3, Alicia Aldana4, María Lezcano4
1 Cátedra y Servicio de Pediatría, Hospital de Clínicas, Facultad de Ciencias Médicas, Universidad Nacional de Asunción, Paraguay
2 Reumatología Pediátrica, Hospital de Clínicas, Cátedra y Servicio de Pediatría, Facultad de Ciencias Médicas, Universidad Nacional de Asunción, Paraguay
3 Cardiología Pediátrica. Hospital de Clínicas, Facultad de Ciencias Médicas, Universidad Nacional de Asunción, Paraguay
4 Neurología Pediátrica, Hospital de Clínicas, Cátedra y Servicio de Pediatría, Facultad de Ciencias Médicas Universidad Nacional de Asunción, Paraguay
Autor para correspondencia. Correo electrónico: javf82@gmail.com (J. Andrés Vega F.)
RESUMEN
Introducción: La Fiebre Reumática (FR) y la Artritis Post-Estreptocócica (ARPE), se caracterizan por auto-anticuerpos secundarios a infección por Estreptococo beta hemolítico del grupo A. En nuestro país, la cardiopatía adquirida por la FR genera cuantiosos gastos para el Estado y la familia, tornándose en un problema de salud pública.
Objetivos: Valorar las características clínico-epidemiológicas y la evolución de pacientes con Fiebre Reumática y ARPE, en la Cátedra y Servicio de Pediatría del Hospital de Clínicas.
Metodología: estudio retrospectivo, observacional, transversal, de pacientes con diagnóstico de FR y ARPE, durante el periodo comprendido entre enero del 2009 y junio del 2014.
Resultados: Se encontraron 22 casos de FR y 4 de ARPE. Edad de diagnóstico: 4 a 16 años. La válvula cardiaca más afectada fue la mitral con 8/22 pacientes. Criterios mayores: artritis migratoria en 13/22, Carditis 4/22, Corea 3/22. Criterios menores: Artralgias 10/22, Fiebre 8/22, VSG elevada 14/22, PCR + 11/22, ECG alterado 6/22. En 24/26 pacientes no se realizó cultivo faríngeo. ASTO + 15/26 de los casos. Tratamiento: todos recibieron penicilina G benzatínica, 9/26 salicilatos, 5/26 corticoides, 2/26 haloperidol. El 33% de los niños con FR presentó falla cardiaca; 10/26 pacientes abandonaron tratamiento. Conclusiones: La FR, sigue siendo una causa importante de cardiopatía adquirida, quizás por el manejo inadecuado de las infecciones estreptocócicas y el diagnóstico tardío de la enfermedad. Llama la atención la falta de búsqueda de la infección (cultivo), el alto porcentaje de abandono del tratamiento, y el diagnóstico inadecuado (ARPE vs FR).
Palabras claves: Fiebre Reumática, Artritis Post-Estreptocóccica, Criterios de Jones
Rheumatic fever and post-streptoccocal arthritis in a third tier hospital
ABSTRACT
Introduction: Rheumatic Fever (RF) and Post-Streptococcal Arthritis (PSRA), are characterized by autoantibodies secondary to Group A β-hemolytic streptococcus (GAS). In our country, the disease acquired by the RF generate substantial costs for the State and family,becoming a public health problem.
Objective: To evaluate the clinical and epidemiological characteristics and outcome of patients with RF and PSRA at the Pediatrics Department of the Hospital de Clínicas.
Methods: A retrospective, observational, transverse study of patients diagnosed with RF and PSRA, during the period between January 2009 and June 2014.
Results: 22 cases of RF and 4 PSRA were found. Diagnostic Age: 4-16 years. The most affected heart valve is the mitral, with 8/22 patients. Major criteria: 13/22 migratory arthritis, carditis 4/22, 3/22 Korea. Minor criteria: 10/22 arthralgia, fever 8/22, elevated ESR 14/22, CRP positive 11/22, 6/22 altered EKG. In 24/26 patients no throat culture was performed. ASO + 15/26 cases. Treatment: all received benzathine penicillin G, salicylates 9/26, 5/26 corticosteroids, 2/26 haloperidol. 23% of children with RF presented heart failure; 10/26 patients discontinued treatment.
Conclusions: RF remains a major cause of acquired heart disease, perhaps by inadequate management of streptococcal infections and delayed diagnosis. Particularly striking is the lack of pursuit of infection (culture), the highest percentage of treatment abandonment, and inadequate diagnosis (PSRA vs RF).
Keywords: Rheumatic Fever, Post-streptococcal Arthritis, Jones criteria.
INTRODUCCIÓN
La Fiebre Reumática (FR) es una enfermedad inflamatoria autoinmune, secundaria a una infección por estreptococo beta-hemolítico del grupo A (EbhGA). En países desarrollados es poco frecuente, con una incidencia de 0,5 casos por 100.000 habitantes, o incluso menor. El pico máximo de incidencia se sitúa entre los 5-15 años y al igual que la faringoamigdalitis aguda (FAA) estreptocócica, es excepcional en menores de 3 años. Es un problema de salud pública en los países en desarrollo, con tasas de incidencia que alcanzan niveles epidémicos1-4.
La FR puede aparecer a cualquier edad, pero predomina en la edad pediátrica. El diagnóstico es clínico y se basa en los criterios de Jones5-10. La importancia de la FR aguda radica en la posibilidad de ocasionar carditis y posterior insuficiencia cardiaca. Cuadros recurrentes de FR pueden ocasionar finalmente una enfermedad cardiaca reumática y Corea4-5.
Este estudio tiene como objetivos valorar las características clínico-epidemiológicas, determinar los hallazgos más frecuentes en el diagnóstico, además de precisar el tratamiento instaurado y las complicaciones más frecuentes, de pacientes con Fiebre Reumática y Artritis Post-estreptocócica en un Hospital de referencia de nuestro país.
MATERIALES Y MÉTODOS
Estudio retrospectivo, observacional, descriptivo, transverso, de expedientes clínicos de pacientes con diagnóstico de Fiebre Reumática y Artritis Reactiva Post-estreptococica, de la Cátedra y Servicio de Pediatría del Hospital de Clínicas (FCM-UNA), de enero de 2009 a junio de 2014.
Población enfocada: pacientes menores de 18 años, con diagnósticos de Fiebre Reumática y Artritis Reactiva Post-estreptocócica, que consultaron al servicio de consulta ambulatoria, urgencias e internados de la Cátedra y Servicio de Pediatría del Hospital de Clínicas, Facultad de Ciencias Médicas (FCM), Universidad Nacional de Asunción (UNA), de enero del 2009 a junio del 2014.
Criterios de inclusión: pacientes menores de 18 años con diagnósticos de Fiebre Reumática y Artritis Reactiva Post-estreptocócica.
Criterios de exclusión: pacientes mayores de 18 años. Pacientes con diagnóstico diferente al de Fiebre Reumática y/o Artritis Reactiva Post-estreptocócica. Expedientes incompletos.
Variables: edad al diagnóstico, sexo, ingreso mensual de la familia, número de personas en la casa, raza, edad actual, recaídas, válvulas cardiacas afectadas, criterios de Jones, tratamiento inicial y actual, abandono de tratamiento, complicaciones, tratamiento de las complicaciones.
RESULTADOS
Se encontraron 22 casos de FR y 4 de ARPE (todos diagnosticados erróneamente como FR en un principio). La población en general se reparte por todos los departamentos y ciudades del país con un porcentaje similar del 4% en Areguá, Asunción, Ayolas, Caacupé, Capiatá, Carapeguá, Cerrito, Chore, Coronel Oviedo, Concepción, Fernando de la Mora, Horqueta, Itapuá, Luque, Lambaré, MRA, Ñemby, Paraguarí, San Antonio, San Pedro, San José de los Arroyos, Tobatí e Ybycuí. La población se reparte de manera similar por todos los departamentos de la Región Oriental.
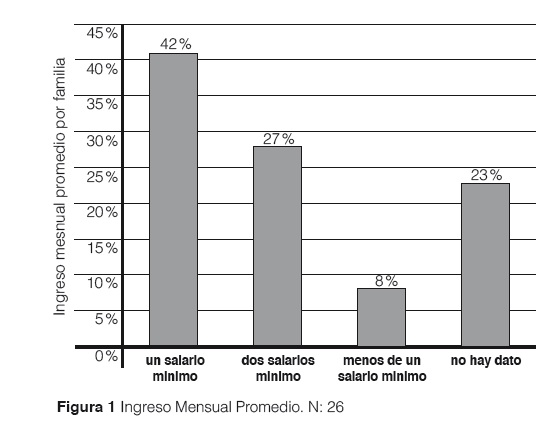
El ingreso mensual promedio por familia que arroja nuestra investigación es 42% de la población que vive con un salario mínimo, 27% con 2 salarios mínimos, un 8% menos de 1 salario mínimo y el 23% donde no se consignan esos datos (Figura 1).

El porcentaje según los integrantes que viven en casa son: tres integrantes con un 19%, cinco integrantes con un 19%, cuatro integrantes con un 23%, seis integrantes con un 8%, siete integrantes con un 8%, ocho integrantes con un 4%, nueve integrantes con un 4% y más de 12 integrantes con un 4%, en el 11% de las historias no existe dicho dato.
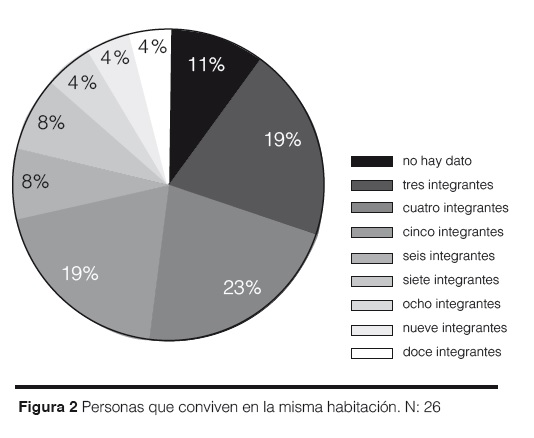
Con respecto al número de personas que duermen en la misma habitación con el niño al que se le ha realizado el diagnóstico de fiebre reumática tenemos que el 23% de estos duermen con tres personas, el 23% también con dos personas, el 15% con una persona, un 12% vive con cuatro personas, un 4% con cinco personas y un 4% con seis personas. Hay un 15% sin datos aportados (Figura 2).
La edad de diagnóstico se halla en un rango de 4 a 16 años, siendo el 19% de los niños de 14 años el grupo etario más frecuente, seguido del 14,3% en los niños de 9 y 10 años, y 9,5% los niños de 8 años. La relación mujer:hombre es de 7:3. Solo un 4% es de raza indígena, y el 96% restante es latina.
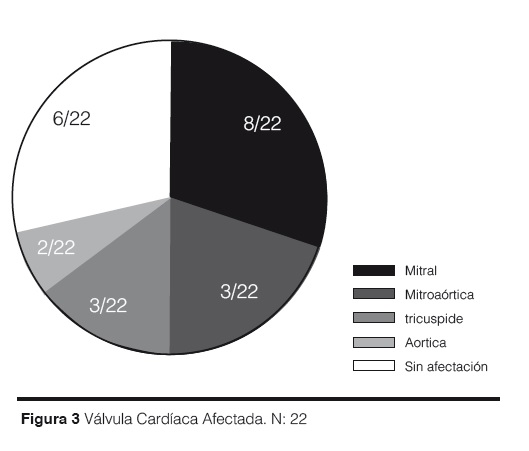
Al momento de valorar las historias, la válvula cardiaca más afectada fue la mitral con 8/22 pacientes, seguida de la mitral y la aórtica al mismo tiempo 3/22, la tricúspide 3/22, la aórtica sola 2/22; y 6/22 pacientes no tiene las válvulas cardiacas afectadas (Figura 3).
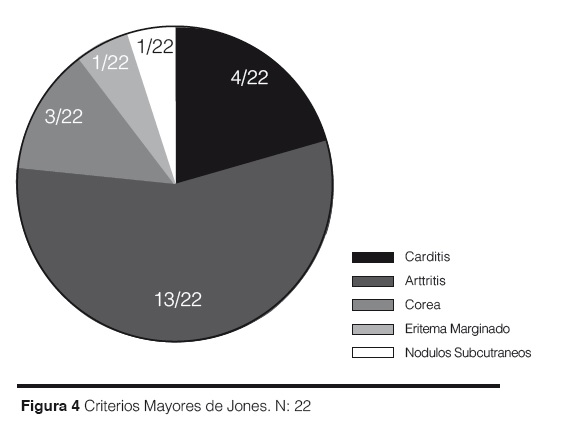
Criterios mayores de Jones: artritis migratoria en 13/22, Carditis 4/22, Corea 3/22, Nódulos subcutáneos 1/22 y Eritema marginado 1/22. (Figura 4).
Como la artritis fue el criterio más frecuente, se investigó la duración de ésta, arrojando los siguientes datos: el 40% de los niños con artritis tuvieron un promedio de duración de cinco días, el 27% duraron siete días, el 13% duraron seis días, el 7% solo cuatro días, el 6% tuvo en promedio de 3 días de duración de la artritis, y un 7% más de siete días de duración. La primera articulación afectada en los niños con artritis migratoria fueron las rodillas en el 47% de los pacientes, el 33% los tobillos, un 13% los codos y un 7% las muñecas.
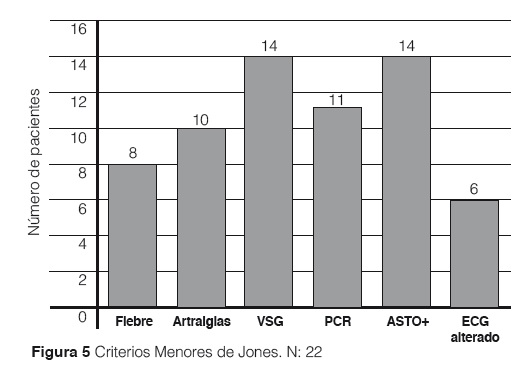
Los Criterios menores de Jones en nuestro estudio: Artralgias 10/22, Fiebre 8/22, VSG elevada 14/22, PCR + 11/22, ECG alterado 6/22. ASTO + 14/22 de los casos, éste sí realizado en todos los pacientes (Figura 5).
En 24/26 de los pacientes no se realizó cultivo faríngeo, y en 2/26 que sí se realizó el resultado fue negativo.
Con respecto al tratamiento todos recibieron penicilina G benzatínica, 9/26 salicilatos, 5/26 corticoides, 2/26 haloperidol, 7/26 otros (ácido valproico).
El 77% (17/22) de los niños con FR no ha tenido falla cardiaca; sin embargo, un 18% (4/22) se encuentra en Insuficiencia Cardiaca Grado IV, y un 4% (1/22) en Grado III.
En relación al apego al tratamiento; el 38% de los pacientes con FR abandonaron el tratamiento, mientras que un 35% continuaron con el mismo, y no se cuentan con datos en el 27% de los casos.
El 9% (2/22) de los pacientes con FR ha requerido cirugía cardiaca (recambio valvular), con un solo fallecido.
DISCUSIÓN
La Fiebre Reumática (FR) es una enfermedad inflamatoria autoinmune, que surge como complicación no supurativa tras una infección por estreptococo beta-hemolítico del grupo A (EbhGA). En países desarrollados es poco frecuente, con una incidencia de 0,5 casos por 100.000 habitantes, o incluso menor. El pico máximo de incidencia se sitúa entre los 5-15 años y al igual que la FAA estreptocócica, es excepcional en menores de 3 años. Es un problema de salud pública en los países en desarrollo, con tasas de incidencia que alcanzan niveles epidémicos. Está íntimamente ligada a las malas condiciones económicas. Unos 30 millones de personas padecen la enfermedad en todo el mundo. En los países desarrollados, la prevalencia de la enfermedad ha disminuido debido a la mejora en las condiciones sociales, económicas y culturales, junto con el uso de antibióticos para las infecciones respiratorias1-4.
La Fiebre Reumática sigue siendo un problema de salud importante en nuestro país. Llama la atención que en nuestro estudio como en otros como el de Borges y col1, Carvalho y col11, el bajo nivel socioeconómico, la pobreza, la cohabitación son factores asociados.
En Estados Unidos, durante las primeras décadas del siglo pasado, su prevalencia era entre 5 a 10 casos por 1.000 habitantes; en la actualidad la prevalencia de cardiopatía reumática es menor de 5 por 100.000 habitantes. En contraste, en los países en desarrollo la tasa de recurrencia de FR es alta y las secuelas cardiacas son la principal causa de insuficiencia y estenosis mitral. Recientemente se estimó que alrededor del mundo existen 15,6 millones de personas con FR, 470.000 nuevos casos de FR y 233.000 muertes atribuibles a la misma. Casi todos estos casos y muertes ocurren en países en desarrollo1-4,12.
Su distribución geográfica es similar a la observada para las infecciones por Estreptococos del grupo A: es favorecida por factores climáticos (humedad, frío, etc.) y socio-económicos (hacinamiento, pobreza, etc), los cuales persisten en los países subdesarrollados y determinan la alta incidencia de FR, que en algunos casos es superior a los 150 casos anuales por 100.000 habitantes1,5, siendo la causa más importante de enfermedad cardíaca adquirida en adultos jóvenes.
La introducción de antibióticos en 1959 rápidamente disminuyó esta patología; por lo tanto, para 1980 la incidencia fue de 0,23 a 1,88 casos por 100.000 habitantes, con la presentación de nuevos casos en niños y adolescentes. Excepción a esta regla incluye a los niños aborígenes en Australia y en Hawai, Nueva Zelanda y poblaciones Maori, todas estas con ancestros de Polinesia. La incidencia de FR aguda en el Pacífico y poblaciones indígenas de Australia y Nueva Zelanda se estimó en 374 por 100.000 habitantes en base a revisiones realizadas en el periodo comprendido de 1985 a 200313-14.
La FR puede aparecer a cualquier edad, pero predomina en la edad pediátrica entre los 5 y 15 años, siendo excepcional antes de los 5 años y rara después de los 30. No hay diferencias en relación a la raza o el sexo.1,13-14 Sin embargo, la Corea de Sydenham es más frecuente en las mujeres15.
En Brasil la prevalencia de FR es del 3 al 5% en niños y adolescentes16. En Paraguay no se cuentan con cifras exactas, ya que no existen estadísticas nacionales, pero se presume que es una cifra similar a la presentada en Brasil, por las condiciones demográficas de ambos países.
La importancia de la FR aguda radica en la posibilidad de ocasionar carditis, siendo la insuficiencia mitral la alteración más frecuente. Cuadros recurrentes de FR pueden ocasionar finalmente una enfermedad cardiaca reumática. No existen test diagnósticos específicos de FR ni signos/síntomas patognomónicos. El diagnóstico es clínico y se basa en los criterios de Jones (1944)5, revisados periódicamente. Cada revisión aumenta la especificidad pero disminuye la sensibilidad4-10,17-19.
Para el diagnóstico, se requiere la confirmación de infección previa por EBHGA junto a 2 criterios mayores, o uno mayor y 2 menores (Tabla 1).
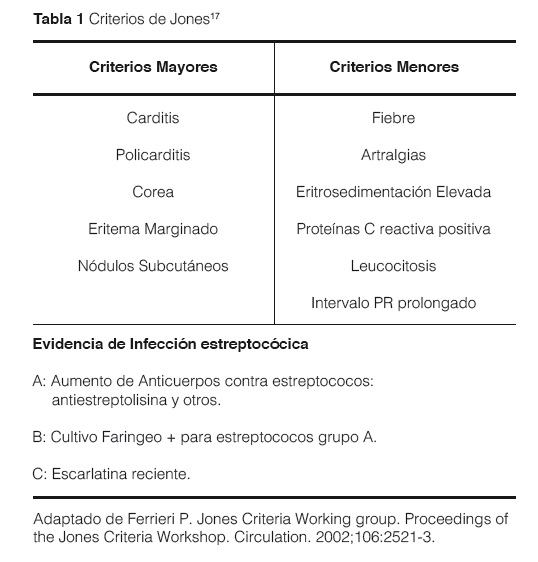
Criterios OMS (2002)4
Corea y carditis indolente no requieren evidencia de infección por Streptococcus del grupo A
Primer episodio
Para el primer episodio se utilizan los Criterios de Jones.
Episodios Recurrentes
En pacientes sin Enfermedad Cardiaca Reumática: como en el primer episodio. En pacientes sin Enfermedad Cardiaca Reumática: requiere 2 manifestaciones menores más la evidencia de infección por Streptococcus del grupo A.
En general se presenta como un cuadro febril, de evolución más o menos insidiosa, los síntomas se inician con malestar general, astenia, adinamia, mialgias, artralgias, hiporexia y fiebre de predominio vespertino, que usualmente no es muy alta y no sobrepasa los 38,5°C. Pueden asociarse cualquiera de las siguientes manifestaciones:
Artritis: es el signo principal, pero el menos específico. Casi siempre afecta grandes articulaciones en forma asimétrica y migratoria (rodillas, codos, muñecas, tobillos). La artritis es benigna y no ocasiona deformidad permanente, si se exceptúa una forma muy poco frecuente llamada artritis de Jaccoud, que por persistencia de la inflamación erosiona las cabezas de los metacarpianos y termina en deformidades típicas de los dedos. Sin tratamiento, el cuadro puede durar 2 a 3 semanas. Un signo notable es su marcada respuesta a los salicilatos o AINES1. En el pasado, la poliartritis migratoria con fiebre era el signo inicial de FR en aproximadamente el 75 % de los pacientes, actualmente es mucho más rara1,9,20-21.
Carditis: es una pancarditis que afecta miocardio, pericardio y endocardio. La intensidad es variable; en su forma más grave puede presentarse la muerte por insuficiencia cardiaca. Afecta las válvulas mitral y aórtica, así como las cuerdas tendinosas de la válvula mitral. La insuficiencia mitral es el signo más característico y se manifiesta por un soplo sistólico regurgitante, audible con mayor intensidad en los focos de la punta, acompañado de un retumbo funcional por hiperreflujo, el cual se denomina retumbo de Carey-Coombs. Cuando cede la fase aguda, la cicatrización va convirtiendo la insuficiencia en estenosis mitral. Se pueden combinar ambos mecanismos. La taquicardia es el signo más temprano de miocarditis. También hay inflamación de la superficie visceral y parietal del pericardio y aparece pericarditis1,5,9,20-21.
Corea de Sydenham: ocurre en el 20% de los pacientes. La manifestación del ataque agudo en el sistema nervioso central es la lesión de los ganglios basales y del núcleo caudado, un fenómeno tardío en la FR. Por lo general aparece entre 1 y 6 meses luego del inicio de la infección estreptocócica. Se caracteriza por movimientos involuntarios, falta de coordinación muscular y labilidad emocional que inician en forma brusca. Afecta sobre todo los músculos de la cara y las extremidades; el habla puede tornarse explosiva y difícil. Aunque la mayoría de los casos se presentan como corea generalizada, la hemicorea también es posible. La aparición de corea o cambios conductuales, sobre todo en un niño con infecciones estreptocócicas recurrentes, siempre debe plantear la sospecha de FR. La debilidad de los músculos se presenta como una incapacidad para sostener una contracción tetánica, conocido clínicamente como un „signo o maniobra de ordeño‘‘ en el que los pacientes no pueden apretar sus puños por un período prolongado, por lo que se relaja y aprieta de forma intermitente cuando se le pide que agarre los dedos del examinador. La corea provoca una incapacidad para realizar movimientos volitivos, dejando caer objetos. El “discurso de Sydenham” se caracteriza por ráfagas de habla disártrica. Otros movimientos posibles incluyen fasciculaciones de la lengua, muecas faciales, balismo, habilidades motoras finas deterioradas, hipotonía, mano coreica (“cuchara” de la mano por la flexión de la muñeca y la extensión de los dedos) y el “signo del pronador” (hiperpronación de las manos cuando los brazos están extendidos por encima de la cabeza). Los factores de estrés, como fiebre, pueden aumentar la severidad de los síntomas, y desaparecen durante el sueño en casos no severos. Varios estudios describen síntomas acompañantes como labilidad emocional, ansiedad, falta de atención, y trastorno obsesivo-compulsivo franco (TOC)22-29.
Nódulos subcutáneos: son firmes, indoloros, se desplazan con facilidad y llegan a medir hasta 2 cm; aunque rara vez aparecen, su presencia debe hacer sospechar carditis. Por lo regular se presentan en la cara extensora de las articulaciones, en particular de codos, rodillas y muñecas9,17.
Eritema marginado: se observa en menos de 5% de los pacientes. Es una erupción evanescente, macular no pruriginoso, de centro pálido y circular, de bordes serpiginosos, fugaz, de corta duración. Su localización ocurre en el tronco, glúteos y la región proximal de las extremidades, pero no en la cara. También es más común en los casos con carditis9,17.
Con respecto a los criterios de Jones encontrados en nuestro estudio, se evidenció que algunos de ellos en frecuencia, son congruentes con la bibliografía tanto latinoamericana como en países de primer mundo, siendo la artritis migratoria el síntoma más frecuente (59%), donde en estudios como el de Brasil de 201211 reportó un 66.4% de frecuencia, o el de Turquía del 200620 que reportó 61.4% (Tabla 2); seguido por la carditis con un 18% que en otros estudios5, 20 mostró un porcentaje mucho más elevado del 46 al 56%. La Corea de Sydenham en nuestra serie de casos mostró un 13% de frecuencia, que comparado con otras series se evidencia proporciones similares a ésta13,14,28,29. Los nódulos subcutáneos y el eritema marginado los menos frecuentes.
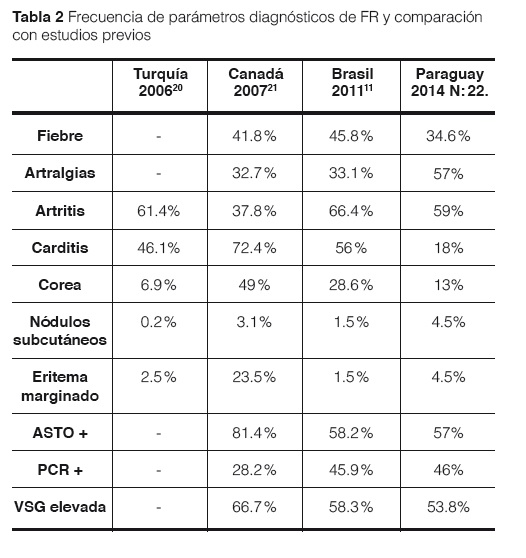
Al igual que en los criterios menores de Jones los síntomas más frecuentes tanto en nuestro estudio como en algunos otros, se encuentra que el síntoma más frecuente fue la artralgia con un 57%, al igual que los ASTOS positivo con 57%, seguido de la fiebre 34.6%, VSG elevada 53.8%, PCR positiva 46%. Alteraciones electrocardiográficas 23%, que comparado con otros estudios se evidencia que el ítem más frecuente de los criterios menores de jones son ASTOS positivos7 con un 58% hasta 81% en el estudio de Canadá 200721 (Tabla 2). Con respecto a las alteraciones electrocardiográficas se evidencia también que lo más frecuente es la prolongación de PR tanto en nuestro estudio como las series publicadas. La ecocardiografía se ha convertido en un método de diagnóstico esencial para la evaluación de pacientes con fiebre reumática, ya que permite un análisis detallado de las lesiones cardiacas y debidas a que es más específico que la evaluación clínica.
En nuestra serie, encontramos que 16/22 de los pacientes tienen una válvula cardiaca afectada (72.7%), demostrando que la actividad inflamatoria inicial o de recurrencia con lesión cardiaca es muy elevada, lo que contribuye a la prevalencia de enfermedad cardiaca en nuestro país. De los pacientes valorados con alteraciones en válvulas cardiacas se evidenciaron que el 36% de los pacientes presentaban regurgitación mitral, 13% tenía lesión doble (mitral y aortica) todos ellos visto por ecocardiograma, sin embargo llama la atención que solo 4/22 (18%) tenían carditis documentada por lo que estos datos están de acuerdo con la de otros autores que se identificaron anomalías valvulares en pacientes con fiebre reumática sin presentación clínica de la carditis, lo que sugiere que algunos pacientes pueden tener un curso subclínico de carditis con lesiones valvulares7,30.
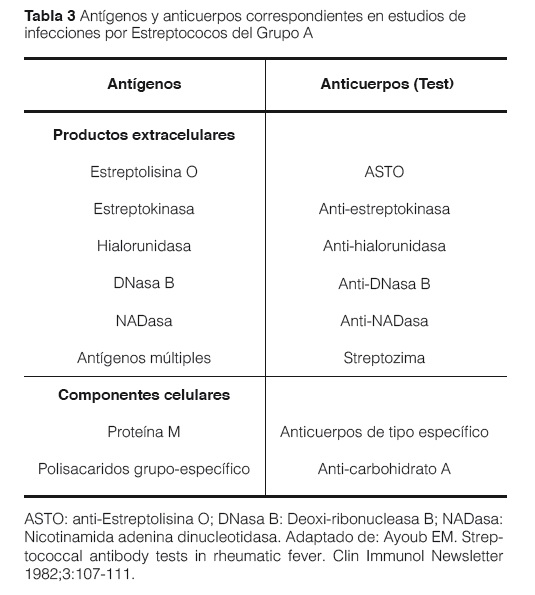
Debido a las diversas manifestaciones de la enfermedad, no existe una prueba específica para establecer un diagnóstico definitivo. Además de un examen físico cuidadoso en el que se preste atención a los ruidos cardiacos, a la piel y las articulaciones, se pueden tomar muestras de sangre como parte de la evaluación, estas incluyen pruebas para infecciones recurrentes por estreptococos (Por ejemplo: ASTO o anti ADNasa B, entre otros) (Tabla 3)31, con un título de Antiestreptolisina O elevados (más de 333 U Todd en niños y 250 U Todd en adultos); es el procedimiento laboratorio más accesible y de menor costo. La estreptolisina O desencadena en el huésped la producción de anticuerpos no específicos denominados anties-treptolisinas O (ASTO), que permiten documentar el contacto con el estreptococo. En la Fiebre Reumática aguda, la positividad de las pruebas aumenta del orden de 82-83% utilizando una sola a 92% sumando ASTO más anti-DNASA B (Tabla 4)1,6,31-33.
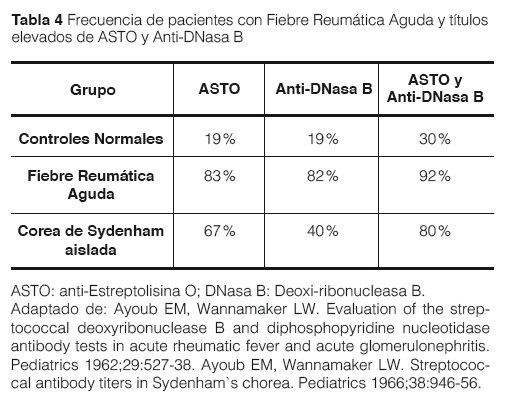
Los indicadores de inflamación aguda, eritrosedimentación y proteína C reactiva, miden la actividad y la evolución de la enfermedad. A todas estas manifestaciones, hay que añadir obligatoriamente, la demostración de una infección estreptocócica previa, evidenciada por: elevación de las antiestreptolisinas O u otros anticuerpos anti-estreptocócicos; cultivo faríngeo positivo para estreptococo del grupo A (“estándar de oro”); o Escarlatina reciente.
La enfermedad es autolimitada y la duración promedio es de alrededor de 8 semanas.1,5 La recurrencia de la FR es relativamente común. Las complica-ciones cardiacas pueden ser severas y a largo plazo, particularmente si hay compromiso de las válvulas del corazón.5 Los episodios de FR tienden a remitir espontáneamente: un 75% antes de 6 semanas y un 90% antes de 12 semanas1,5,7. La mortalidad es baja (menor al 1%) y se debe a casos de carditis grave. Alrededor del 30% de los pacientes jóvenes o niños terminan con daño valvular permanente. Las lesiones en orden de frecuencia son: estenosis mitral (23%), insuficiencia mitral (19%), doble lesión mitral (53%), doble lesión aórtica y estenosis tricuspídea7-9.
Criterios de actividad de la enfermedad:
• Artritis
• Nuevos soplos
• Cardiomegalia en aumento
• Insuficiencia cardíaca
• Nódulos subcutáneos
• Temperatura rectal: ≥ 38°C
• FC >100 lpm durante el sueño
• Reactantes de fase aguda elevados
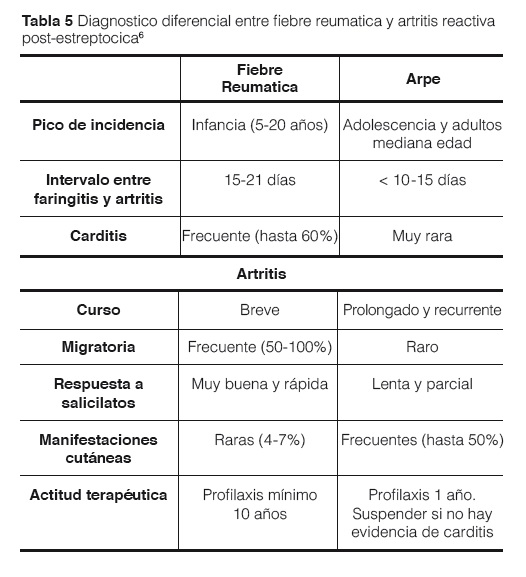
El diagnóstico diferencial debe establecerse con la Artritis Reactiva Post-Estreptocócica (ARPE). Aunque actualmente está en discusión si la ARPE es una entidad diferente de la FR o una forma leve de la misma, algunas características pueden ayudar a distinguirlas. El periodo de latencia entre infección estreptocócica e inicio de los síntomas suele ser < 10 días en la ARPE y > 2 semanas en la FR. Cada episodio de artritis suele ser prolongado, recurrente y con escasa respuesta al tratamiento en la ARPE, mientras que en la FR es breve, y es muy característica la espectacular respuesta a salicilatos o AINES. El riesgo de afectación cardiaca en la ARPE es muy bajo o nulo. A pesar de ser una entidad rara en nuestro medio, se debe pensar en FR ante la presencia de síntomas compatibles. Se estima que la carditis puede ocurrir hasta en el 60% de los la casos1,5-7,30,34 (Tabla 5).
Otro patología que cabe mencionar son los trastornos neuropsiquiátricos pediátricos autoinmunes asociados con infecciones estreptocócicas (PANDAS por sus siglas en inglés: Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptococcal infections) se ha utilizado para describir un síndrome caracterizado por diversas obsesiones, compulsiones, tics, hiperactividad, estereotipias motoras y trastornos del movimiento paroxístico que se correlacionan con la infección previa por el Streptococcus beta-hemolítico del grupo A34-40.
Cinco criterios clínicos pueden ser usados para diagnosticar PANDAS39-40:
1. la presencia de trastorno obsesivo-compulsivo (TOC) y / o cualquier otros trastornos de tics;
2. inicio pediátrico (entre los 3 años de edad y el comienzo de la pubertad);
3. comienzo brusco y el curso de los síntomas de recaída-remisión;
4. asociación clara con infección por SBHGA; y
5. asociación con alteraciones neurológicas durante las exacerbaciones (movimientos adventicios o hiperactividad motora).
La patogénesis exacta de PANDAS no está claro, y varias teorías que se centran en múltiples factores etiológicos o contributivas han surgido. El actual estándar de tratamiento para los pacientes con PANDAS sigue siendo la terapia de conducta sintomática y cognitiva, tales como exposición y prevención de respuesta, junto con la orientación familiar y la psicoeducación, debe ser el primer enfoque para el tratamiento de PANDAS, además de la terapia antimicrobiana e inmunológica (corticoides, plasmaféresis, IGIV), factibles en casos severos34-40.
Otras patologías que se deben descartar como diagnósticos diferencias Fiebre Reumática, incluyen:4-7
• Artritis Idiopática Juvenil.
• Artritis reactiva post-estreptococica.
• Lupus Eritematoso Sistémico.
• Enfermedad de Kawasaki.
• Enfermedad Mixta del Tejido Conectivo.
• Artritis infecciosas (gonococos, brucelosis, etc).
• Leucemia
• Anemia de células falciformes con crisis ósea.
• Carditis infecciosas virales, bacterianas.
• Endocarditis infecciosa.
• Coreas de otra causa autoinmune (LES, Sx antifosfolipido, etc).
Tratamiento Antiinfeccioso
Prevención primaria: Consiste en el tratamiento adecuado de todas las faringoamigdalitis estreptocócicas (o sospechosas de estreptocócicas). El antibiótico de elección es la Penicilina. Basta una inyección de Penicilina Benzatínica (600.000 UI intramuscular en menores de 27kg, y 1.200.000 UI en pacientes con ≥ 27kg de peso. Cuando hay alergia a la penicilina, se recurre a macrólidos. (Tabla 6)41-47.
Prevención secundaria: Consiste en la prevención de recaídas tras un primer ataque de FR aguda. Se basa en el uso prolongado de antibióticos para evitar nuevas infecciones estreptocócicas (Tabla 6)41-47.
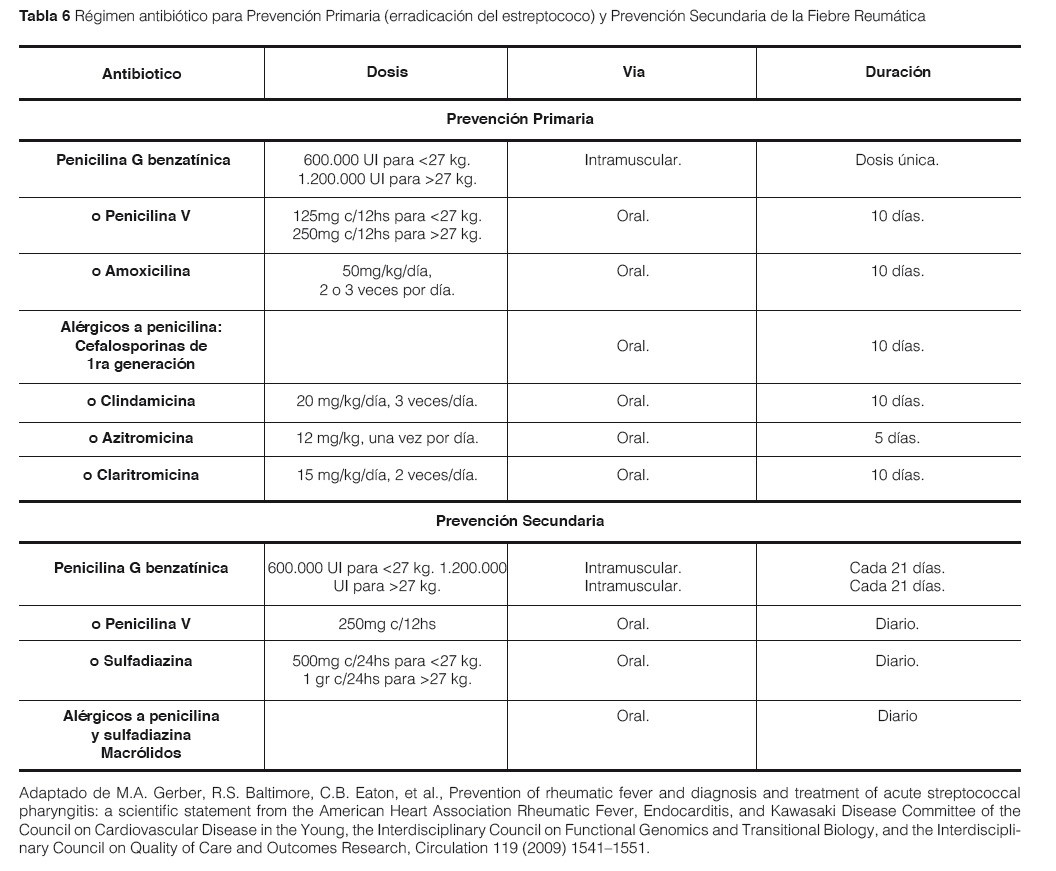
Las recomendaciones actuales para la profilaxis de la endocarditis bacteriana (Profilaxis terciaria) se limitan a pacientes con reemplazo valvular, los que tienen antecedentes de endocarditis o los que tuvieron trasplante de corazón. No hay evidencia para indicar la administración sistemática de dosis suplementarias de antibióticos de forma rutinaria a todos los niños con FR, para alguna cirugía o procedimiento dental. Si la profilaxis de endocarditis está indicada, se prefieren los antibióticos no penicilínicos ya que los pacientes con FR normalmente ya están en profilaxis con penicilina47-48.
Duración: sin carditis ni toque neurológico, 10 años desde el último brote o hasta los 20-25 años de edad (la opción que sea más prolongada). Con carditis o Corea de Sydenham, toda la vida (ya que se han comprobado brotes de FR con carditis en pacientes de edad adulta). En caso de ARPE, las guías actuales recomiendan iniciar profilaxis tras el diagnóstico, y retirarla si tras un año de seguimiento no se demuestran complicaciones47.
En nuestro estudio, se encontró un alto índice de incumplimiento de la profilaxis antibiótica con penicilina benzatínica (38%), lo que lleva a un mayor riesgo de recurrencia y de complicaciones cardiacas, lo que puede explicarse por la falta de campañas para educar a la población, bajo nivel social y económico y la mala educación de la familia en la población estudiada. Especial atención debe prestarse a la profilaxis primaria de la fiebre reumática aguda que en todos los casos se dio, sin embargo no se conoce si fue a la dosis debida. Por otro lado, el diagnóstico de la enfermedad estreptocócica en este estudio mostró que el 92% de los pacientes no se le realizó cultivo faríngeo, demostrando así la falta de búsqueda del mismo. Al igual que la falta de nuevos métodos diagnósticos para detectar la enfermedad. La población debe ser informada a través de los medios masivos de comunicación comunidades, dando prioridad a la atención de pacientes en unidades de cuidados de salud y hospitales públicos, lo que permite a la población necesitada de tener acceso a las políticas de salud pública, lo que mejora el cumplimiento del tratamiento.
Tratamiento Antiinflamatorio: fundamentalmente con ácido acetilsalicílico (AAS), AINES y/o prednisona. Para decidir la administración de un medicamento u otro, Nuget propuso clasificar a la carditis en leve, moderada y grave. Carditis leve es aquella en la que se ausculta un soplo de Carey Coombs o de insuficiencia mitral (grado 2/6 o menos) en ausencia de cardiomegalia. En la carditis grave hay cardiomegalia e insuficiencia cardiaca congestiva. La carditis moderada es de intensidad intermedia entre las dos anteriores y no se acompaña de insuficiencia cardiaca congestiva. Se recomienda administrar AAS a dosis de 100 mg/kg/día cuando no hay carditis (solo poliartritis), la carditis es leve o se halla carditis moderada con más de tres semanas de duración. Por otra parte, se utiliza prednisona, a dosis de 1-2mg/Kg/día, si la carditis es moderada y tiene menos de tres semanas de dura-ción (con la esperanza de reducir la gravedad de la posterior carditis reumática crónica), en la carditis grave (por suponer que reduce la mortalidad) y en la pericarditis,porque suele estar asociada a endo y miocarditis importantes.
El AAS se administra
en dosis fraccionadas cada 4-6 hs, vigilando la salicilemia si es posible, de manera que se sitúe entre 25
y 35 mg/dl. El tratamiento se mantiene hasta 8 semanas a fin de evitar el
“fenómenos de rebote”. El efecto clínico del AAS es espectacular y en 24-72 hs ceden la fiebre y la artritis. La normalización de los
datos biológicos es más lenta. Tiene el inconveniente de que puede producir
gastritis, acufenos y sordera transitoria, además de hiperpnea
con posible alcalosis respiratoria por estimulo del centro respiratorio. La prednisona se administra a dosis elevadas (1-2 mg/Kg/día)
hasta que se consigue la desaparición de las manifestaciones inflamatorias, lo
que suele ocurrir en unos 4-7 días. Luego se reduce paulatinamente la dosis
hasta conseguir la mínima eficaz. El tratamiento suele durar entre 4 y 12 semanas
y algunos autores aconsejan seguir con AAS unas cuan-
tas semanas más; que tendría por objeto evitar el
“efecto rebote” que aparece luego de la suspensión de la prednisona12,17,41-46.
Reposo en cama: se aconseja que el paciente realice reposo total las primeras 2-4 semanas. Si hay carditis, el reposo debe extremarse y mantenerse 8-10 semanas, aunque esto es muy individualizado para cada paciente.
Otras medidas: si hay insuficiencia cardiaca congestiva, se controlará la dieta asódica, administración de inotrópicos y diuréticos e incluso, implantación de prótesis valvulares. Un enfermo reumático puede cursar con los criterios mayores más la Corea de Sydenham o bien, exclusivamente con Corea. La patogénesis de la Corea de Sydenham no es claramente conocida, con base autoinmune. El valproato sódico actúa sobre el sistema gabaergico inhibiendo la hiperactividad dopaminérgica (la que controla los movimientos involuntarios), Por lo tanto, se considera una droga eficaz y segura para el tratamiento de la Corea de Sydenham, convirtiéndose en el tratamiento de primera línea. Los pacientes que no responden a este medicamento o que se presentan con la corea grave (especialmente paralítica corea, en la que el tono muscular está tan disminuida que los pacientes están postrados en cama) deben ser tratados con risperidona. Otros fármacos bloqueadores del receptor de la dopamina, como el haloperidol, también pueden ser útiles. Hay una creciente evidencia de que el tratamiento inmunosupresor, como la metilprednisolona intravenosa seguida de prednisona oral, es eficaz. Esta opción se ha utilizado en pacientes que no respondieron a (o no toleran) las terapias mencionadas anteriormente. La plasmaféresis y la inmunoglobulina intravenosa se consideran como tratamientos experimentales. En el trabajo de Van Immerzeel y colaboradores vieron que con el uso de IGIV 400mg/kp/día durante 5 días tuvo un efecto positivo, dado por la desaparición de los síntomas en los pacientes tratados, por lo que se destaca la IGIV como una opción de tratamiento serio para la Corea de Sydenham12,17,23,49-51.
CONCLUSIONES
La FR, sigue siendo una causa importante de cardiopatía adquirida en nuestro medio, quizás por el manejo inadecuado de las infecciones estreptocócicas, además del diagnóstico tardío de la enfermedad. Llama la atención la falta de búsqueda de la infección (cultivo), la necesidad de contar con anti-DNasa B además del ASTO, el alto porcentaje de abandono del tratamiento, y el diagnóstico inadecuado (ARPE vs FR).
RECOMENDACIONES
• ASTO elevado no significa presencia de Fiebre Reumática.
• La Fiebre Reumática no siempre tiene ASTO elevado.
• No todos los pacientes cumplen en forma estricta los Criterios de Jones.
• Corea de Sydenham generalmente es tardía y aislada.
• De rutina debe estudiarse el compromiso cardiaco con Ecocardiograma-doppler.
BIBLIOGRAFÍA
(1) Borges F, Barboza MLA, Borge RB, et al. Clinical and Demographic Characteristics of 99 Episodes of Rheumatic Fever in Acre, the Brazilian Amazon. Arq. Bras. Cardiol. 2005;84(2).
(2) Pereira BAF, da Silva NA, Andrade LEC, et al. Jones Criteria and Underdiagnosis of Rheumatic Fever. Indian J Pediatr. 2007;74(2):117-121.
(3) Kumar V, Carreño M. Rheumatic Fever. Curr Treat Options Cardio vasc Med. 1999;1:253–58.
(4) WHO. Rheumatic fever and rheumatic heart disease: report of a WHO Expert Consultation, Geneva, 29 October–1 November 2001. G eneva: World Health Organization. 2004.
(5) Jones TD. The diagnosis of acute rheumatic fever. JAMA. 1944;126:481–4.
(6) Rutstein DD. Report of the committee on standards and criteria for programs of care of the council of rheumatic fever and congenital heart disease of American Heart Association: Jones criteria (modified) for guidance in the diagnosis of rheumatic fever. Circulation. 1956;13: 617–20.
(7) Stollerman GH, Markowitz M, Taranta A, Wannamaker LW, Whittemore R. Committee report: Jones criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation. 1965;32:664–68.
(8) Committee on rheumatic fever and bacterial endocarditis of the American Heart Association. Jones criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation. 1984;69:03A–208A.
(9) G uidelines for the diagnosis of rheumatic fever. Jones Criteria, 1992 update. Special Writing Group of the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young of the American Heart Association.
JAMA. 1992;268(15):2069–73.
(10) Dajani AS, Ayoub EM, Bierman FZ, et al. Guidelines for the diagnosis of rheumatic fever: Jones Criteria, updated 1992. JAMA. 1992;87:302–307.
(11) Carvalho S, et al. Rheumatic fever presentation and outcome: a case-series report, Rev Bras Reumatol. 2012;52(2):236-246.
(12) Bernal M, Dominguez MT. Fiebre Reumatica. Correa LF. Guias para manejo de Urgencias tomo 3. Federación Panamericana De Asociaciones De Facultades [Escuelas] De Medicina FEPAFEM, Colombia, 2009, páginas 64-70.
(13) Atatoa-Carr P, Lennon D, Wilson N, on behalf of the New Zealand Rheumatic Fever Guidelines Writing Group. Rheumatic fever diagnosis, management, and secondary prevention: a New Zealand guideline. NZMJ. 2008;121(1271):59-69.
(14) Carapetis JR, Brown A, Wilson NJ, Edwards KN, on behalf of the Rheumatic Fever Guidelines Writing Group. An Australian guideline for rheumatic fever and rheumatic heart disease: an abridged outline. MJA. 2007;186: 581–586.
(15) Loiselle CR, Singer HS. Genetics of childhood disorders: XXXI. Autoimmune disorders, part 4: is Sydenham chorea an autoimmune disorder? J Am Acad Child Adolesc Psychiatry. 2001;40:1234–1236.
(16) Ministério da Saúde. Coordenação de Doenças Crônico-Degenerativas. Incidencia na febre reumática no Brasil. MS: 2003; Brasília/DF. 17. Ferrieri P. Jones Criteria Working group. Proceedings of the Jones Criteria Workshop. Circulation. 2002;106:2521-3.
(18) Markowitz M. Evolution of the Jones Criteria for the diagnosis of acute rheumatic fever. In: Narula J, Virmani R, Reddy KS, Tandon R, eds. Rheumatic fever. Washington: American Registry of Pathology. 1999: 299–306.
(19) Shiffman RN. Guideline maintenance and revision: 50 years of the Jones criteria for diagnosis of rheumatic fever. Arch Pediatr Adolesc Med. 1995;149:727–32.
(20) Olgunturk R, Canter B, Tunaoglu FS, Kula S. Review of 609 patients with rheumatic fever in terms of revised and updated Jones criteria. Int J Cardiol. 2006;112(1):91–8.
(21) Carceller A, Tapiero B, Rubin E, Miró J. Acute rheumatic fever: 27 year experience from Montreal’s pediatric tertiary care centers. Ann Pediatr (Barc). 2007;67(1):5–10.
(22) Dale RC. Immune-mediated extrapyramidal movement disorders, including Sydenham chorea. Handb Clin Neurol. 2013;112:1235-41.
(23) Cardoso F. Sydenham‘s Chorea. Curr Treat Options Neurol. 2008;10(3):230-5.
(24) Ramanan PV, Premkumar S, Ramnath B. Youngest patient with Sydenham‘s chorea: a case report. J Indian Med Assoc. 2009;107(4):246, 253.
(25) Swedo SE, Leonard HL, Schapiro MB, et al. Sydenham’s chorea: physical and psychological symptoms of St Vitus dance. Pediatrics. 1993;91:706–713.
(26) Stollerman GH. Rheumatic fever. Lancet. 1997;349:935–942.
(27) Swedo SE. Sydenham’s chorea. A model for childhood autoimmune neuropsychiatric disorders. JAMA. 1994;272:1788–1791.
(28) Nausieda PA, Grossman BJ, Koller WC, et al. Sydenham chorea: na update. Neurology. 1980;30:331–334.
(29) Aron AM, Freeman JM, Carter S. The natural history of Sydenham’s chorea. Review of the literature and long-term evaluation with emphasis on cardiac sequelae. Am J Med. 1965;38:83–95.
(30) Hilário MO, Terreri MT. Rheumatic fever and post-streptococcal arthritis. Best Pract Res Clin Rheumatol. 2002;16(3):481–94.
(31) Ayoub EM. Streptococcal antibody tests in rheumatic fever. Clin Immunol Newsletter. 1982;3:107-111.
(32) Ayoub EM, Wannamaker LW. Evaluation of the streptococcal deoxyribonuclease B and diphosphopyridine nucleotidase antibody tests in acute rheumatic fever and acute glomerulonephritis. Pediatrics. 1962;29:527-38.
(33) Ayoub EM, Wannamaker LW. Streptococcal antibody titers in Sydenham`s chorea. Pediatrics. 1966;38:946-56.
(34) Barash J, Mashiach E, Navon-Elkan P, et al. For the Pediatric Rheumatology Study Group of Israel. Differentation of Post-Streptococcal Reactive Arthritis from Acute Rheumatic Fever. J Pediatr. 2008;153:696-9.
(35) Esposito S, Bianchini S, Baggi E, Fattizzo M, Rigante D. Pediatric autoimmune neuropsychiatric disorders associated with streptococcal infections: an overview. Eur J Clin Microbiol Infect Dis. 2014;33(12):2105-9.
(36) Marconi D, et al. PANDAS: a possible model for adult OCD pathogenesis. Riv Psichiatr. 2009;44(5):285-98.
(37) Martino D, et al. The PANDAS subgroup of tic disorders and childhood-onset obsessive-compulsive disorder. J Psychosom Res. 2009;67(6):547-57.
(38) Pichichero ME. The PANDAS syndrome. Adv Exp Med Biol. 2009;634:205-16.
(39) Shulman ST. Pediatric autoimmune neuropsychiatric disorders associated with streptococci (PANDAS): update. Curr Opin Pediatr. 2009;21(1):127-30.
(40) van Toorn R, Weyers HH, Schoeman JF. Distinguishing PANDAS from Sydenham’s chorea: case report and review of the literatura. E ur J Paediatr Neurol. 2004; 8:211–16.
(41) Romero C, et al. Fiebre reumática, Consenso nacional 2005. Rev costarric. cardiol. 2005;7(1):59-62.
(42) Nordet P, Lopez R, Sarmiento L. 42. Prevention and control of rheumatic fever and rheumatic heart disease: the Cuban experience (1986-1996-2002): cardiovascular topic. Cardiovasc J Afr. 2008; 19(3):135-140.
(43) Guilherme L, Ramasawmy R, Kalil J. Rheumatic fever and rheumatic heart disease: genetics and pathogenesis. Scand J Immunol. 2007;66:199-207.
(44) Carceller-Blanchard A. Fiebre reumática aguda. An Pediatr (Barc). 2007;67:1-4.
(45) Carceller A, Tapiero B, Rubin E, Miró J. Fiebre reumática aguda: 27 años de experiencia en los hospitales de Montreal. An Pediatr (Barc). 2007;67:5-10.
(46) Guía de atención de la fiebre reumática. Ministerio de Salud –Dirección General de Promoción y Prevención. República de Colombia. 1999.
(47) M.A. Gerber, R.S. Baltimore, C.B. Eaton, et al., Prevention of rheumatic fever and diagnosis and treatment of acute streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Transitional Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research, Circulation 119 (2009) 1541–1551.
(48) G lenny AM, Oliver R, Roberts GJ, Hooper L, Worthington HV. Antibiotics for the prophylaxis of bacterial endocarditis in dentistry. Cochrane Database Syst Rev.2013;10:CD003813.
(49) Sabui TK, Pant P. Sodium valproate in the treatment of Sydenham‘s chorea. Indian J Pediatr. 2010;77(6):703.
(50) Van Immerzeel TD, van Gilst RM, Hartwing NG. Beneficial use of immunoglobulins in the treatment of Sydenham chorea. Eur J Pediatr. 2010;169(9):1151-4.
(51) Walker K, Brink A, Lawrenson J, Mathiassen W, Wilmshurst JM. T reatment of sydenham chorea with intravenous immunoglobulin. J Child Neurol. 2012;27(2):147-55.
Fecha de envío: 10/10/2015 - Fecha de aprobación: 10/11/2015